Glossario Radiologico – settembre 2025
Il Golden S sign è un segno radiologico osservabile alla radiografia del torace, classicamente associato al Carcinoma del polmone
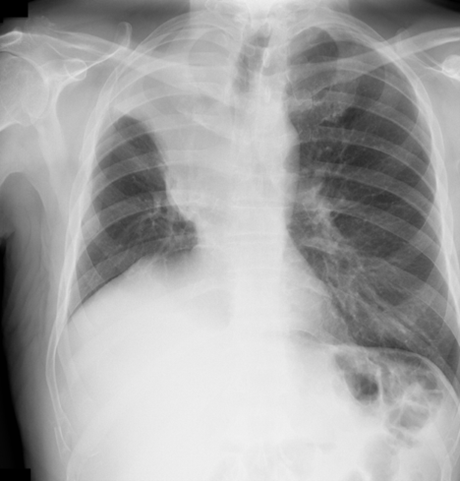
- Si osserva in presenza di un collasso del lobo superiore destro
- La scissura orizzontale appare deviata verso l’alto ma con un contorno concavo alterato dalla presenza di una massa.
- Questa deformazione crea un profilo che ricorda una “S” rovesciata
- Il segno è stato descritto da Ross Golden nel 1925.
Una massa centrale (di solito un tumore bronchiale) ostruisce il bronco lobare superiore destro → causa atelettasia del lobo. La scissura orizzontale si solleva e si incurva a causa della trazione del collasso e della compressione dalla massa tumorale.
Aspetto radiologico:
- La porzione mediale della scissura è convessa verso il basso (spinta dalla massa),
- mentre la porzione laterale è concava verso l’alto (sollevata dal collasso).
- Il risultato è una configurazione a “S” sulla radiografia PA o laterale del torace.
Il Golden S Sign non è patognomonico, ma è fortemente suggestivo di neoplasia polmonare centrale. Può essere visto anche in altri contesti patologici (rari), ma il tumore resta la causa principale
Paziente di 60, emottisi e calo ponderale. Come si chiama questo pattern?

a. Golden S sign
b. Silhouette sign
c. Air bronchogram sign
d. Meniscus sign
e. Hilum overlay sign
Risposta esatta: a
La sindrome di Waterhouse-Friderichsen è una condizione medica rara ma gravissima, caratterizzata da insufficienza surrenalica acuta fulminante dovuta a emorragia massiva delle ghiandole surrenali, spesso in contesto di sepsi meningococcica.
- La causa più comune è l’infezione da Neisseria meningitidis (meningococco), ma può anche essere provocata da:
- Haemophilus influenzae
- Streptococcus pneumoniae
- Pseudomonas aeruginosa
- Staphylococcus aureus
- Virus (molto più raramente)
Fisiopatologicamente in corso di sepsi fulminante, si verifica coagulazione intravascolare disseminata (CID). Questa porta a emorragia bilaterale surrenalica, con perdita della funzione endocrina. Ne consegue un collasso circolatorio improvviso dovuto a:
-
- Ipotensione refrattaria
- Ipoaldosteronismo → iperkaliemia, iponatriemia
- Ipocortisolemia → shock e morte
Quadro clinico tipico:
| Febbre alta improvvisa | Segno di infezione sistemica |
| Petecchie / porpora fulminante | Tipica della sepsi meningococcica |
| Ipotensione grave → shock | Refrattario alla terapia |
| Alterazioni dello stato mentale | Confusione, letargia, coma |
| Dolore addominale / lombare | Possibile irradiazione da surrene emorragico |
| Segni di CID (coagulopatia diffusa) | Sanguinamenti spontanei, ecchimosi |
Aspetto Radiologico:
La Radiologia ed in particolare la TC hanno un ruolo essenziale potendo documentare una massiva emorragia surrenalica bilaterale
Paziente di 60, emottisi e calo ponderale. Come si chiama questo pattern?
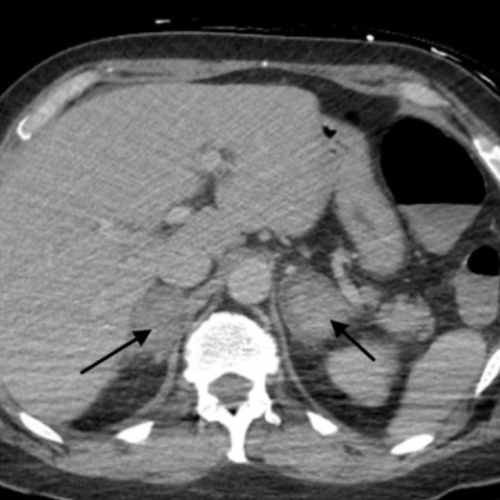
Qual è la diagnosi più probabile?
- sindrome di Waterhouse-Friderichsen
- feocromocitoma bilaterale
- metastasi surrenaliche bilaterali da melanoma
- iperplasia surrenalica congenita
- adenoma surrenalico
Risposta esatta: a
SIRM INSIGHT
Dal radiologo invisibile al radiologo indispensabile: la sfida del futuro
Qual è oggi il ruolo reale del radiologo nella medicina moderna? A questa domanda prova a rispondere un editoriale appena pubblicato su La Radiologia Medica e firmato da Nicoletta Gandolfo, presidente della SIRM, che delinea la trasformazione di questa figura da semplice interprete di immagini a protagonista clinico a tutto tondo.
Un’evoluzione di identità
Per decenni il radiologo è stato percepito come un tecnico dietro le quinte, lontano dal contatto diretto con il paziente. Oggi la disciplina è radicalmente cambiata: il radiologo è un clinico integrato nei percorsi decisionali, parte attiva dei board multidisciplinari e guida nella scelta delle strategie terapeutiche più appropriate.
Molto più che immagini
Le competenze richieste vanno oltre l’interpretazione tecnica: servono capacità trasversali per inserire il dato radiologico nel contesto clinico, selezionare l’esame più appropriato, ridurre rischi e inutili esposizioni e contribuire alla sostenibilità del sistema sanitario. Il radiologo diventa così mediatore clinico e garante della qualità e sicurezza.
L’alleanza con l’innovazione
L’editoriale sottolinea anche il ruolo crescente di nuove tecnologie: dall’imaging molecolare alla radiomica, fino all’intelligenza artificiale. Strumenti che non sostituiscono il medico, ma lo affiancano nell’individuare pattern invisibili all’occhio umano, prevedere l’evoluzione delle malattie e personalizzare le cure. L’AI, se usata in modo regolato e consapevole, riduce la variabilità, aumenta l’efficienza e valorizza il giudizio clinico del radiologo.
Radiologia come terapia
Non solo diagnosi: oggi la radiologia comprende anche interventi terapeutici mininvasivi – biopsie mirate, ablazioni, embolizzazioni – sempre più supportati da evidenze scientifiche e linee guida. Tecniche che riducono complicanze, tempi di degenza e offrono alternative meno invasive alla chirurgia.
Il ritorno al paziente
Un punto cruciale riguarda la “umanizzazione” della radiologia. Spiegare, ascoltare, comunicare i limiti e i benefici degli esami: aspetti un tempo trascurati, oggi centrali. Narrative medicine ed empatia diventano strumenti imprescindibili per rafforzare il rapporto con il paziente.
Un ruolo di leadership
Il radiologo è chiamato a esercitare leadership clinica e culturale: partecipare alla costruzione dei percorsi diagnostici, formare colleghi, dialogare con le istituzioni e promuovere la cultura scientifica nella popolazione. Una responsabilità che rende questa figura sempre meno invisibile e sempre più indispensabile.
Il messaggio chiave?
Il radiologo non è più un tecnico “dietro lo schermo”, ma un clinico, innovatore, comunicatore e leader. Una trasformazione che rappresenta non solo un cambio di ruolo, ma un vero cambio di identità.
Per approfondire:
Nicoletta Gandolfo. From invisible to indispensable: the radiologist’s great challenge. La Radiologia Medica, 2025.
https://doi.org/10.1007/s11547-025-02070-3
Intelligenza artificiale e fratture dello scafoide: quali prospettive nella pratica clinica reale?
Qual è l’impatto reale degli algoritmi di intelligenza artificiale (AI) nella diagnosi delle fratture dello scafoide? A questa domanda ha cercato di rispondere un lavoro pubblicato su La Radiologia Medica, che ha valutato due software di AI (BoneView e RBfracture) nel supporto a radiologi non specialisti nell’interpretazione di radiografie del polso.
Una sfida diagnostica complessa
Le fratture dello scafoide rappresentano circa il 70% delle fratture carpali e fino al 20% può risultare non visibile alle radiografie iniziali. Il rischio? Mancata diagnosi, con conseguenze gravi come pseudoartrosi, necrosi e artrosi del carpo. In pronto soccorso, dove spesso non è presente un radiologo esperto di muscolo-scheletrico, il rischio di errore aumenta.
Lo studio: 264 pazienti, 764 radiografie
Il gruppo di ricerca dell’Università di Pavia ha analizzato 264 pazienti con trauma al polso, confrontando le prestazioni di due radiologi non specialisti (NSR) con e senza supporto AI. I casi sono stati suddivisi in due gruppi:
- Gruppo 1: diagnosi chiara su radiografia standard (frattura presente/assente).
- Gruppo 2: casi dubbi o negativi ma con sintomi persistenti, confermati con TC.
I risultati: AI utile soprattutto nei casi complessi
- Nei casi chiari (Gruppo 1): l’AI ha mostrato performance simili ai radiologi non specialisti (AUC ~0.83–0.90), senza miglioramenti significativi.
- Nei casi complessi (Gruppo 2): qui l’AI ha fatto la differenza. L’accuratezza diagnostica degli NSR, inizialmente bassa (AUC 0.46–0.63), è migliorata in modo significativo con l’assistenza AI, raggiungendo AUC 0.72–0.75.
- Accordo diagnostico: con il supporto AI, la concordanza tra NSR e radiologi specialisti è passata da moderata a sostanziale (Kappa di Cohen fino a 0.71).
BoneView o RBfracture?
I due software hanno mostrato caratteristiche diverse:
- BoneView: maggiore sensibilità, quindi utile in urgenza per ridurre i falsi negativi.
- RBfracture: maggiore specificità, più adatto a contesti specialistici per ridurre i falsi positivi.
Il messaggio chiave? Promettente, ma non definitivo
L’AI può migliorare l’accuratezza diagnostica dei radiologi meno esperti, soprattutto nei casi difficili, riducendo il rischio di fratture occulte non riconosciute. Tuttavia, la sua performance rimane inferiore rispetto agli specialisti, e non sostituisce la necessità di un percorso diagnostico corretto con imaging di secondo livello (TC o RM).
In sintesi: l’intelligenza artificiale si conferma un alleato prezioso, soprattutto nei contesti d’urgenza e dove mancano competenze muscoloscheletriche avanzate. Ma non è la soluzione definitiva: resta uno strumento di supporto, non un sostituto del radiologo esperto.
Per approfondire:
Ana Isabel Hernáiz Ferrer et al. Application of artificial intelligence in the diagnosis of scaphoid fractures: impact of automated detection of scaphoid fractures in a real-life study. La Radiologia Medica, 2025.
https://doi.org/10.1007/s11547-025-02028-5
L’Intelligenza Artificiale nel Breast Imaging: Raccomandazioni per la Pratica Clinica
Qual è il reale impatto dell’intelligenza artificiale (AI) sull’imaging senologico? A questa domanda ha cercato di rispondere un’approfondita review pubblicata su European Radiology, con raccomandazioni pratiche da parte della Società Europea di Breast Imaging (EUSOBI) e della Società Europea di Radiologia (ESR).
Il lavoro, firmato da Simone Schiaffino e colleghi, valuta il potenziale dell’AI nel migliorare la diagnosi e ottimizzare i flussi di lavoro, affrontando il carico di lavoro eccessivo dei radiologi e la potenziale imprecisione diagnostica.
Screening mammografico: potenziale e risultati
L’AI si sta affermando come uno strumento potente nello screening per il cancro al seno. I modelli di AI hanno dimostrato di migliorare l’accuratezza diagnostica e l’efficienza del flusso di lavoro. Alcuni studi indicano che l’AI, utilizzata come secondo lettore, può ridurre il carico di lavoro del radiologo fino all’88% mantenendo un’accuratezza non inferiore. Il MASAI trial, uno studio randomizzato su larga scala, ha mostrato che lo screening supportato dall’AI ha una capacità di rilevamento del cancro non inferiore (6.1 vs. 5.1 per 1000 partecipanti) e riduce il carico di lavoro di lettura dei radiologi del 44%. Tuttavia, l’articolo sottolinea che sono ancora necessari studi sui risultati a lungo termine.
Le altre modalità: dalla tomosintesi alla risonanza magnetica
L’articolo analizza anche l’applicazione dell’AI in altre modalità di imaging:
- Tomosintesi digitale del seno (DBT): I sistemi AI possono ridurre significativamente i tempi di lettura (fino al 23-29%) mantenendo l’accuratezza. Sebbene promettenti, mancano studi di valutazione post-implementazione.
- Ultrasuoni (US): I sistemi AI approvati a livello normativo possono migliorare la classificazione delle lesioni mammarie e ridurre il numero di biopsie non necessarie. Anche in questo caso, la carenza di studi di sorveglianza post-implementazione rende difficile una valutazione definitiva.
- Risonanza Magnetica (MRI): Le soluzioni AI per la risonanza magnetica mammaria rimangono in gran parte nel campo della ricerca. I CAD commerciali offrono un valore diagnostico aggiunto limitato per i radiologi esperti. Le applicazioni avanzate, come la previsione del sottotipo molecolare e la risposta al trattamento, mostrano risultati promettenti ma sono ancora in fase di studio.
- Mammografia con mezzo di contrasto (CEM): Lo sviluppo dell’AI per la CEM è ancora in una fase molto precoce. Le ricerche preliminari hanno esplorato la classificazione dei sottotipi molecolari basata sulla radiomica, ma sono necessari ulteriori sviluppi prima che queste tecniche possano essere testate in un ambiente clinico.
Il messaggio chiave: l’AI come aiuto, non come sostituto
La conclusione degli autori è chiara: l’uso degli strumenti AI nell’imaging senologico deve essere considerato un ausilio non obbligatorio per il radiologo refertante. A causa della mancanza di prove sull’impatto a lungo termine, le conclusioni dell’AI possono sempre essere superate dal radiologo, che deve considerare tutte le informazioni cliniche a sua disposizione.
L’implementazione dell’AI, sebbene benefica, deve essere accompagnata da una rigorosa sorveglianza post-commercializzazione e dal monitoraggio continuo di parametri rilevanti come tassi di richiamo, tassi di biopsia e tassi di rilevamento del cancro. La Società Europea di Radiologia e la Società Europea di Breast Imaging hanno approvato questo documento, sottolineando la necessità di ulteriore ricerca per portare gli algoritmi disponibili dal campo della ricerca a prodotti clinici utili.
Per approfondire: https://doi.org/10.1007/s00330-025-11954-x
Screening del cancro al polmone con TC a bassa dose: raccomandazioni pratiche
Qual è il ruolo dello screening per il cancro al polmone con TC a bassa dose nella pratica clinica? A questa domanda ha risposto una rassegna pubblicata su European Radiology, contenente le raccomandazioni pratiche della European Society of Thoracic Imaging (ESTI).
Il documento, firmato da Marie-Pierre Revel e colleghi, evidenzia che lo screening con TC a bassa dose riduce il rischio di morte per cancro al polmone di almeno il 21% nei soggetti ad alto rischio. Lo screening è raccomandato per le persone di età compresa tra i 50 e i 75 anni con almeno 20 anni-pacchetto di fumo.
Punti chiave: sicurezza e gestione dei noduli
- Dose di radiazione: è fondamentale mantenere la dose efficace al di sotto di 1 mSv, utilizzando algoritmi di ricostruzione iterativi o basati su deep learning.
- Ruolo dell’IA: gli algoritmi di deep learning sono necessari per facilitare la rilevazione dei noduli e la misurazione della loro crescita volumetrica. L’IA può fungere da secondo lettore per aumentare la sensibilità e ridurre i tempi di lettura.
- Gestione dei noduli: la gestione dei noduli solidi si basa sul loro volume. I noduli di grandi dimensioni (superiori a 500 mm³) o con caratteristiche sospette (spiculazioni, retrazione pleurica) richiedono un’ulteriore valutazione diagnostica. I noduli tra 100 e 500 mm³ richiedono un follow-up a breve termine.
- Noduli subsolidi: per la maggior parte dei noduli subsolidi è raccomandato un approccio di “watchful waiting” per limitare il rischio di sovra-trattamento, poiché rappresentano forme indolenti di adenocarcinoma polmonare. Il monitoraggio a lungo termine di questi noduli è una strategia sicura.
Altre considerazioni
La descrizione di reperti aggiuntivi deve essere limitata per garantire la redditività dello screening. La radiologia svolge un ruolo attivo nella guida e nell’ottimizzazione delle pratiche di screening , e la refertazione strutturata è fondamentale per migliorare la qualità e i risultati.
Per approfondire: https://doi.org/10.1007/s00330-025-11910-9

