Il Valore Aggiunto della DWI nella Diagnosi dei Tumori Mammari Mancati dall’AI: Nuove Evidenze per una Senologia più Sicura e Sostenibile
L’integrazione dell’intelligenza artificiale (AI) nei programmi di screening mammografico promette di ridurre il carico di lavoro dei radiologi e aumentare l’accuratezza diagnostica. Tuttavia, anche i sistemi più avanzati non sono infallibili: alcuni tumori sfuggono ancora alla rilevazione automatica, soprattutto in presenza di caratteristiche di imaging sfavorevoli.
Un recente studio pubblicato su La Radiologia Medica ha analizzato 414 donne con carcinoma mammario confermato per comprendere quali tumori vengano mancati dai sistemi di diagnosi assistita da software di intelligenza artificiale (AI-CAD) e se la diffusion-weighted imaging (DWI) possa rappresentare un supporto efficace e sostenibile in questi casi.
Lo studio si è concentrato sulla capacità della DWI, valutata come tecnica standalone, di individuare tumori che la mammografia con AI-CAD non ha riconosciuto, con l’obiettivo di definire possibili integrazioni nei percorsi diagnostici futuri.
Il Contesto: Limiti Residui dell’AI tra Densità Mammaria e Lesioni Occulte
L’adozione dell’AI nel mammografico è in forte crescita, sostenuta da studi che dimostrano una detection rate comparabile alla doppia lettura con una riduzione significativa del carico di lavoro. Tuttavia, alcune categorie di lesioni rappresentano ancora una sfida:
- Seni densi, dove la radiopacità maschera la presenza di lesioni.
- Tumori di piccole dimensioni, spesso privi di caratteristiche morfologiche evidenti.
- Lesioni mammograficamente occulte, non visibili nelle proiezioni standard.
In questi scenari, la mancata rilevazione da parte dell’AI potrebbe avere impatto clinico, richiedendo strategie di imaging complementari che siano al tempo stesso efficaci, accessibili e sostenibili.
I Risultati: Tumori AI-Missed e il Ruolo Chiave di Dimensioni e Densità
Tra i 414 tumori analizzati, il 30,7% non è stato rilevato dall’AI-CAD. Due elementi sono risultati predittori indipendenti di mancata detection:
- Densità mammaria elevata (OR 1,619; p = 0,049)
- Dimensioni tumorali ≤ 2 cm (OR 4,698; p < 0,001)
Quasi la metà di questi tumori (46,5%) era mammograficamente occulta, confermando l’importanza della complessità strutturale del tessuto mammario tra i principali fattori limitanti.
DWI come Tecnica Standalone: Oltre il 79% di Detection dei Casi Mancati dall’AI
La parte centrale dello studio ha valutato se la DWI, letta in modo indipendente da due radiologi, potesse identificare i tumori non rilevati dall’AI:
- 83,5% dei tumori AI-missed identificati dal Radiologo 1
- 79,5% identificati dal Radiologo 2
- Accordo interosservatore sostanziale (κ = 0,61)
La DWI ha dimostrato particolare efficacia in:
- tumori >1 cm,
- lesioni invasive,
- tumori mammograficamente occulti,
- casi con seno denso, dove la mammografia risulta maggiormente limitata.
Le prestazioni si riducono invece nei tumori subcentimetrici, dove la risoluzione spaziale della tecnica rappresenta ancora un limite.
Gli autori evidenziano che la DWI non è proponibile come screening autonomo, ma può rappresentare un valido strumento di triage nei casi in cui l’AI non rileva alcuna anomalia pur in presenza di fattori di rischio o incongruenze cliniche.
Questa integrazione potrebbe aumentare sicurezza e appropriatezza senza introdurre un significativo carico aggiuntivo sul sistema.
Implicazioni Cliniche e Messaggio Chiave
Messaggio chiave: l’AI rappresenta un importante passo avanti nella diagnosi senologica, ma non può sostituire del tutto l’interpretazione clinica e la complementarietà delle diverse tecniche di imaging. La DWI si presenta come un’opzione sostenibile e potenzialmente efficace per identificare una quota significativa di tumori non rilevati dall’AI-CAD, soprattutto in donne con seno denso o con lesioni mammograficamente occulte.
L’integrazione strutturata tra AI-CAD, mammografia e tecniche RM non contrasto potrebbe:
- migliorare la sicurezza diagnostica,
- ridurre i falsi negativi,
- personalizzare i percorsi in base al rischio,
- promuovere una senologia sempre più basata sull’evidenza e sulla sostenibilità.
Lo studio sottolinea la necessità di trial multicentrici prospettici in popolazioni reali di screening per confermare questi risultati preliminari e definire protocolli condivisi.
Per approfondire:
Kim J.Y., Kim J.J., Lee H.J. et al.
Added value of diffusion-weighted imaging in detecting breast cancer missed by artificial intelligence-based mammography.
La Radiologia Medica (2025).
https://doi.org/10.1007/s11547-025-02161-1
ECV Miocardico da TC Total Body Senza Gating ECG: Un Nuovo Biomarcatore Precoce di Cardiotossicità da Chemioterapia
La crescente sopravvivenza dei pazienti oncologici rende sempre più rilevante l’identificazione precoce della cardiotossicità indotta dai trattamenti. Tradizionalmente, il monitoraggio si affida all’ecocardiografia e alla risonanza magnetica cardiaca (CMR), ma entrambi presentano limiti: la RM è meno accessibile e più costosa, mentre l’ecocardiografia può non rilevare alterazioni subcliniche nelle fasi iniziali.
Un recente studio pubblicato su La Radiologia Medica propone una soluzione innovativa: stimare il volume extracellulare miocardico (ECV) utilizzando semplici valori di attenuazione ottenuti da TC total body non gated, spesso già eseguite routinariamente nei pazienti oncologici. L’obiettivo è valutare se questa metrica possa identificare precocemente alterazioni tissutali correlate a cardiotossicità.
Il Contesto: Cardiotossicità e Imaging Opportunistico
Il danno cardiaco da chemioterapia può manifestarsi con una progressiva espansione del compartimento extracellulare, segno di fibrosi e infiltrazione. L’ECV valutato alla CMR è uno dei biomarcatori più sensibili, ma la metodica non è facilmente accessibile.
L’idea innovativa dello studio è sfruttare un esame già ampiamente disponibile nella pratica oncologica quale la TC total body per ottenere una stima indiretta dell’ECV, senza necessità di sincronizzazione ECG, breath-hold o l’utilizzo di protocolli dedicati.
Questo approccio “opportunistico” potrebbe fornire un’informazione preziosa senza costi aggiuntivi e permettere un monitoraggio più tempestivo.
Lo Studio: 36 Pazienti, TC in Fase Tardiva e Analisi Semi-Automatica delle Attenuazioni
Lo studio ha incluso 36 pazienti oncologici sottoposti a TC total body dopo somministrazione di mezzi di contrasto iodati in fase tardiva. In ciascun paziente sono state:
- acquisite misurazioni di attenuazione (in HU) del setto interventricolare;
- valutati i valori sierici di ematocrito per la stima dell’ECV;
- raccolti dati clinici legati ai trattamenti chemioterapici.
La stima dell’ECV è stata ottenuta utilizzando formule derivate dal rapporto tra attenuazione miocardica e sanguigna, replicando il metodo utilizzato in CMR.
I Risultati: ECV Significativamente Aumentato nei Pazienti con Danno Cardiaco Subclinico
I principali risultati mostrano che:
- i pazienti con segnali precoci di cardiotossicità presentavano valori di ECV significativamente più elevati rispetto a quelli senza danno;
- la correlazione tra ECV da TC e fattori clinici di rischio è risultata statisticamente significativa;
- la misurazione è risultata riproducibile, con buona concordanza inter-osservatore.
Nonostante l’assenza di gating ECG, l’analisi ha evidenziato che le variazioni nelle misurazioni dovute al movimento cardiaco non impediscono una valutazione affidabile.
Secondo gli autori, l’ECV da TC potrebbe identificare alterazioni subcliniche anche in pazienti con funzione ventricolare ancora normale.
Interpretazione: Una Risorsa Accessibile per la Cardio-Oncologia
Questo metodo presenta diversi vantaggi:
- Utilizza esami già in uso nella routine oncologica, senza esposizioni addizionali.
- Richiede solo misure di HU, facilmente ottenibili.
- Può evidenziare danno subclinico, che né ecocardiografia né frazione di eiezione riescono a cogliere nelle fasi iniziali.
- Potrebbe permettere un intervento precoce, riducendo la progressione verso disfunzione ventricolare conclamata.
I limiti principali riguardano:
- la dimensione campionaria ridotta,
- l’eterogeneità dei protocolli TC,
- l’assenza di confronto sistematico con CMR nello stesso gruppo di pazienti.
Tuttavia, come studio preliminare, apre la strada a un nuovo utilizzo della TC oncologica: non solo per stadiare la malattia, ma anche per monitorare organi “a rischio” come il cuore.
Implicazioni Cliniche e Messaggio Chiave
Messaggio chiave: la stima dell’ECV miocardico da TC total body senza gating ECG emerge come un potenziale biomarcatore precoce e accessibile della cardiotossicità da chemioterapia. Integrare questa valutazione nelle TC di routine potrebbe migliorare il monitoraggio cardiaco, favorendo una gestione più tempestiva dei pazienti oncologici.
Lo studio dimostra che:
- informazioni rilevanti per la cardio-oncologia possono essere estratte da esami già presenti nei percorsi diagnostici,
- l’ECV da TC può individuare alterazioni subcliniche prima della comparsa di riduzioni della funzione ventricolare,
- l’imaging opportunistico rappresenta una frontiera promettente, sostenibile e di grande impatto clinico.
Ulteriori studi prospettici e multicentrici sono necessari per standardizzare protocolli, definire cut-off e validare definitivamente questo approccio.
Per approfondire:
Aquaro G.D., Faggioni L., Francischello R. et al.
Attenuation-based estimation of myocardial extracellular volume from ECG-ungated whole-body CT examinations as an early biomarker of chemotherapy-induced cardiotoxicity: preliminary findings.
La Radiologia Medica (2025).
https://doi.org/10.1007/s11547-025-02148-y
CTSI e Pancreatite Acuta: Quando Eseguire la TC per Massimizzare Accuratezza Prognostica?
Un’Analisi Sistemica su Tempistiche, Severità e Outcome
La pancreatite acuta (AP) è una condizione clinica ad elevata variabilità evolutiva, con un 15–20% dei pazienti che sviluppa forme severe associate a necrosi pancreatica, insufficienza d’organo e mortalità significativa. In questo contesto, la Tomografia Computerizzata con mezzo di contrasto (CECT) e il Computed Tomography Severity Index (CTSI) rappresentano strumenti fondamentali per la stratificazione del rischio. Ma quanto conta il momento in cui la TC viene eseguita?
A dare una risposta è una recente meta-analisi su 28 studi e oltre 5.400 pazienti, pubblicata su Abdominal Radiology, che ha valutato la performance prognostica del CTSI in relazione alle diverse tempistiche di acquisizione.
Il Contesto: la Tempistica come Variabile Critica nella Valutazione della Pancreatite Acuta
La fisiopatologia della pancreatite acuta è dinamica: le alterazioni morfologiche evolvono nell’arco di giorni, passando dall’edema infiammatorio alla necrosi. Questo rende complessa la definizione del timing ideale per l’esecuzione della TC, punto su cui le linee guida presentano raccomandazioni non sempre univoche.
- Una TC troppo precoce (< 48 h) rischia di sottostimare la necrosi.
- Una TC tardiva (> 72 h) è più accurata per le complicanze locali, ma può ritardare decisioni cliniche cruciali.
- In mezzo, una “finestra” in cui la valutazione può ottimizzare sia la tempestività che l’accuratezza.
Questa meta-analisi mira proprio a chiarire quale sia il momento in cui il CTSI offre la massima utilità predittiva per severità, mortalità, insufficienza d’organo e necrosi pancreatica.
I Risultati: la Prestazione del CTSI Cambia Significativamente con la Tempistica
- Predizione della Severità della Malattia
Il CTSI ha mostrato un’ottima performance complessiva (AUC 0.85), ma con profonde differenze in funzione del timing:
- ≤ 48 ore → Massima sensibilità (0.82)
- ≤ 72 ore → Massima specificità (0.86)
- > 72 ore → buona accuratezza complessiva, ma con minor sensibilità
Interpretazione:
La valutazione precoce è utile per identificare rapidamente i pazienti destinati a un decorso severo, mentre quella a 72 ore migliora l’affidabilità nel confermare la diagnosi.
- Predizione della Mortalità
Anche per la mortalità la tempistica incide profondamente:
- ≤ 72 ore → migliore sensibilità (0.90)
- ≤ 48 ore → migliore specificità (0.77)
Messaggio chiave:
Per identificare i pazienti più a rischio di morte, una TC entro 72 ore sembra il compromesso ottimale tra sensibilità e tempestività.
- Predizione dell’Insufficienza d’Organo
La disfunzione d’organo è il principale determinante di mortalità.
- ≤ 48 ore → massima sensibilità (0.90)
- ≤ 72 ore → massima specificità (0.84)
- > 72 ore → stabilità dei valori, ma minore utilità clinica
Interpretazione:
La valutazione precoce (< 48h) è cruciale per intercettare tempestivamente chi evolverà in insufficienza d’organo.
- Predizione della Necrosi Pancreatica
Qui l’effetto della tempistica è particolarmente evidente:
- > 72 ore → massima sensibilità per necrosi (0.93)
- ≤ 48 ore → massima specificità (0.90)
Messaggio clinico essenziale:
Per confermare o escludere la necrosi pancreatica, la TC oltre le 72 ore rimane la scelta più affidabile.
CTSI vs Modified CTSI (MCTSI): Differenze Chiave
L’analisi ha confrontato anche CTSI e MCTSI:
- MCTSI = migliore sensibilità per severità e mortalità
- CTSI = migliore sensibilità per necrosi (grazie al grading del tessuto non vitale)
- MCTSI = minore dipendenza dal mezzo di contrasto, quindi più sicuro nei pazienti fragili
Conclusione:
Il MCTSI è un’alternativa solida e più sicura, ma il CTSI resta lo strumento più accurato per la valutazione della necrosi.
Implicazioni Cliniche e Messaggio Chiave
Non esiste un’unica “tempistica ideale” per eseguire la TC nella pancreatite acuta: dipende dall’outcome che si vuole prevedere.
In sintesi:
- ≤ 48h → ottimale per predire severità precoce e insufficienza d’organo
- ≤ 72h → migliore compromesso per predire mortalità
- > 72h → gold standard per identificare necrosi pancreatica
Questa meta-analisi sottolinea la necessità di:
- standardizzare le tempistiche delle TC nel percorso diagnostico,
- integrare i dati morfologici con biomarcatori clinici e funzionali,
- sviluppare modelli dinamici predittivi basati sull’evoluzione temporale della malattia.
Un approccio personalizzato, basato sul timing ottimale e sulla specifica domanda clinica, può migliorare significativamente la gestione dei pazienti con pancreatite acuta.
Per approfondire:
Huang S., Liu X., Zhu L., Ai K.
Comparison of the predictive value of different assessment times in the severity and prognostic outcomes of CTSI in patients with acute pancreatitis: a systematic review and meta-analysis.
Abdominal Radiology (2025).
https://doi.org/10.1007/s00261-025-05296-x
Oltre il TNM: La Nuova Frontiera Prognostica nel Cancro al Colon Resecabile tramite TC-Radiomica e Sarcopenia
La previsione accurata della sopravvivenza complessiva (OS) post-operatoria nel carcinoma del colon è cruciale per guidare le decisioni terapeutiche e l’implementazione di strategie di cura personalizzate. A questa esigenza risponde uno studio di recente pubblicazione su La Radiologia Medica.
Il lavoro, firmato da Xiaoling Zhi, Tong Nie, Mingming Song e colleghi, ha sviluppato e validato un modello clinico-radiomico integrato con l’obiettivo di predire l’OS nei pazienti con carcinoma del colon resecabile, dimostrando il valore aggiunto dell’integrazione di dati morfologici e metabolici.
Il Contesto: Oltre lo Stadio TNM con Biometriche e Radiomica
La prognosi dei pazienti oncologici è classicamente stratificata in base allo stadio TNM. Tuttavia, l’eterogeneità biologica e la condizione fisica del paziente richiedono l’identificazione di biomarcatori prognostici non invasivi che possano affinare la stratificazione del rischio.
Lo studio si è concentrato su due potenti strumenti derivati dalla TC:
- Composizione Corporea: Misurata tramite TC non contrastata a livello della terza vertebra lombare (L3) offre indicatori metabolici. Parametri come la Densità del Muscolo Scheletrico (SMD) sono proxy della sarcopenia, un fattore noto per peggiorare l’outcome oncologico.
- Radiomica: L’estrazione di feature quantitative dalle immagini TC con contrasto (fase venosa portale) fornisce una quantificazione non invasiva dell’eterogeneità del tumore, offrendo informazioni predittive sulla sua aggressività biologica.
Lo studio ha avuto il merito di combinare sistematicamente questi due approcci per costruire una valutazione prognostica più robusta del solo stadio anatomico.
I Risultati: L’Impatto di SMD e VFA e il Modello Integrato
Lo studio retrospettivo, che ha incluso 296 pazienti con carcinoma del colon resecabile, ha confermato che specifici parametri di composizione corporea sono fattori prognostici indipendenti:
- Bassa Densità del Muscolo Scheletrico (SMD) è risultata significativamente associata a una peggiore OS (HR=0.398, P=0.035).
- Bassa Area di Grasso Viscerale (VFA) è anch’essa associata a una peggiore OS (HR=0.238, P<0.001).
I pazienti con bassi valori di SMD e VFA hanno mostrato un tasso di OS a 3 anni significativamente inferiore, evidenziando il ruolo della condizione fisica nella prognosi.
La Performance del Nomogramma Integrato
Il modello predittivo finale, denominato Modello 3 (visualizzato come nomogramma), è stato costruito integrando la composizione corporea, i fattori clinici (come stadio TNM) e le features radiomiche. La sua performance prognostica è risultata nettamente superiore:
| Modello | 3-year OS AUC (Validation Cohort) | C-index (Training Cohort) |
| Integrato (Model 3) | 0.828 | 0.802 |
| Clinico + Body Comp. (Model 2) | 0.804 | 0.772 |
| Radiomica (Model 1) | 0.658 | 0.741 |
Il Modello 3 ha mostrato un miglioramento significativo della performance rispetto ai modelli che consideravano i dati singolarmente, confermando che l’approccio combinato fornisce la massima accuratezza predittiva.
Implicazioni Cliniche e Messaggio Chiave
Messaggio chiave: L’integrazione della composizione corporea e della radiomica in un nomogramma TC-derivatato offre uno strumento non invasivo e robusto per la stratificazione del rischio prognostico nel carcinoma del colon resecabile.
L’elevato C-index del Modello 3 (0.802) ne indica l’alta affidabilità clinica. Questo nomogramma permette ai radiologi e agli oncologi di:
- Identificare Precocemente il Rischio: Stratificare i pazienti che, nonostante uno stadio TNM favorevole, potrebbero beneficiare di un follow-up più intensivo o di trattamenti adiuvanti più aggressivi.
- Personalizzare la Cura: Fornire una base per interventi nutrizionali mirati prima o dopo l’intervento chirurgico, in particolare per i pazienti con bassa SMD (sarcopenici).
Lo studio evidenzia come la TC stia evolvendo da strumento puramente diagnostico a potente biomarcatore prognostico, offrendo una visione completa che include non solo il tumore, ma anche lo stato metabolico e fisico generale del paziente.
Per approfondire:
Zhi X., Nie T., Song M. et al.
The prognostic value of CT-measured body composition combined with radiomics in predicting the survival of patients with resectable colon cancer.
La Radiologia Medica (2025).
https://doi.org/10.1007/s11547-025-02135-3](https://doi.org/10.1007/s11547-025-02135-3)
Glossario radiologico
CASO 1
Uomo di 56 anni, trapiantato renale da 1 anno, in terapia con tacrolimus e prednisone.
Da 10 giorni presenta cefalea ingravescente, febbricola, difficoltà nel linguaggio e lieve emiparesi destra. Nessun focolaio respiratorio noto.
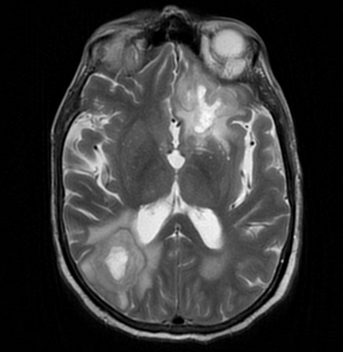
Questa è la RM cerebrale:
Qual è la diagnosi più probabile?
- Ascessi batterici piogeni multipli
B. Nocardiosi cerebrale
C. Toxoplasmosi cerebrale
D. Linfoma primitivo del SNC
Risposta esatta: B
La nocardiosi cerebrale è un’infezione opportunistica sostenuta da batteri filamentosi Gram-positivi del genere Nocardia, tipica dei pazienti immunodepressi (trapiantati, HIV, terapia corticosteroidea).
Segni radiologici caratteristici
- Lesioni multiple con necrosi centrale e margini irregolari.
- Enhancement ad anello frastagliato (“fuzzy ring”), meno uniforme rispetto agli ascessi piogeni classici.
- Cheerios sign: anello periferico iperintenso ben definito con centro meno evidente, che conferisce un aspetto a “ciambella”. È considerato un reperto relativamente caratteristico della nocardiosi cerebrale.
- Importante edema vasogenico circostante.
- Restrizione alla diffusione di grado moderato, non tipicamente intensa come negli ascessi piogeni.
- Possibili microfoci emorragici intralesionali.
Diagnosi differenziali
- Ascessi batterici piogeni: anello più sottile e regolare, intensa restrizione diffusiva centrale.
- Toxoplasmosi cerebrale: lesioni spesso nei gangli della base, possibile “target sign” ma senza Cheerios sign; minori irregolarità periferiche.
- Linfoma primitivo del SNC: enhancement solido, restrizione alla diffusione molto evidente, necrosi rara nelle forme immunocompetenti.
CASO 2
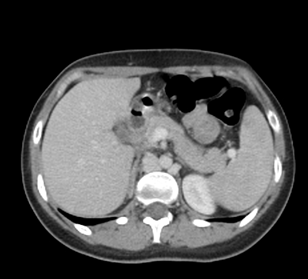
Donna di 46 anni, senza patologie note, sottoposta a TC torace-addome per valutazione pre-operatoria in ambito bariatrico. L’esame viene eseguito con mezzo di contrasto.
Qual è la diagnosi più probabile?
- Trombosi cronica della vena cava inferiore con circolo collaterale
B. Sindrome mediastinica da compressione cronica
C. Variazione congenita: continuità azygos della vena cava inferiore
D. Malformazione artero-venosa del mediastino
Risposta corretta: C
La continuità azygos della vena cava inferiore (nota anche come Azygos continuation of the IVC) è una variante congenita rara, appartenente allo spettro delle anomalie delle vene cave derivate da alterazioni dello sviluppo embriologico del segmento epatico della IVC.
Caratteristiche radiologiche tipiche
- Assenza del segmento epatico della IVC, con brusca interruzione sopra il tratto renale.
- Dilatazione significativa della vena azygos o, più raramente, dell’emizygos.
- Drenaggio del ritorno venoso addominale attraverso la vena azygos nella vena cava superiore.
- Fegato e vene sovraepatiche normali, con normale sbocco nella vena cava superiore tramite il sistema delle vene epatiche e/o direttamente nell’atrio destro a seconda della variante anatomica.
- Assenza di segni di trombosi o circoli collaterali irregolari (che sarebbero tipici della trombosi cronica).
Importanza clinica
- Generalmente asintomatica.
- Rilevante in procedure cardiovascolari o interventi chirurgici, poiché può rendere difficoltoso l’accesso tramite vena femorale (cateterismi, TIPS, filtri cavali).
- Può essere associata a congenitalità complesse, in particolare a polisplenia e malrotazione intestinale (non presenti in questo caso).
Diagnosi differenziale
- Trombosi cronica del segmento epatico della IVC:
In questo caso sarebbero presenti collaterali irregolari, parete cavale ispessita o calcificata e pattern di drenaggio non ordinato. - Compressione extrinseca del mediastino:
Produce collaterali toraciche ma non l’assenza segmentaria della IVC. - Malformazioni vascolari:
Presentano morfologia complessa e non un’anatomia sistematica come la continuità azygos.
CASO 3
Uomo di 72 anni, iperteso severo, con storia di aterosclerosi diffusa. Si presenta al pronto soccorso con dolore toracico acuto irradiato alla schiena, insorto da circa 3 ore. Non febbre, non trauma recente.
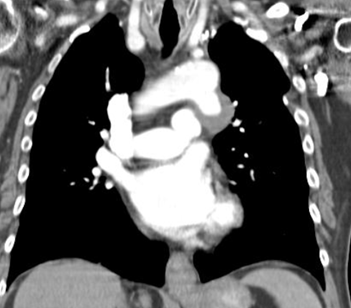
Questa è l’Angio-TC:
Qual è la diagnosi più probabile?
- Trauma contusivo dell’aorta toracica
B. Aneurisma sacciforme infetto (micotico)
C. Dissezione acuta di tipo B
D. PAU
Risposta corretta: D
L’ulcera penetrante dell’aorta (PAU) è una complicanza dell’aterosclerosi avanzata in cui un’ulcerazione dell’intima penetra nella media. La presenza concomitante di un ematoma intramurale e una protrusione focalmente sacciforme indica un’evoluzione verso rottura contenuta, un quadro di emergenza.
Segni radiologici caratteristici
- Discontinuità del contorno interno dell’aorta con irregolarità dell’intima.
- Ematoma intramurale adiacente, ben definito, spesso iperdenso in TC senza contrasto.
- Aneurisma sacciforme focale a rischio di evoluzione in rottura franca.
- Assenza di flap intimale tipico della dissezione.
- Segmentazione tipica nella aorta toracica discendente, spesso nel tratto aterosclerotico.
Diagnosi differenziale
- Dissezione tipo B: presenza di flap intimale, non osservato in questo caso.
- Aneurisma micotico: solitamente più irregolare, con stranding periaortico marcato e possibile gas; paziente febbrile.
- Lesione traumatica dell’aorta: richiede anamnesi di trauma ad alta energia; la sede preferenziale è l’istmo aortico.
Significato clinico
La PAU con rottura contenuta è un’urgenza vascolare che può richiedere trattamento endovascolare (TEVAR) tempestivo per prevenire rottura libera.
CASO 4
Bambino di 8 anni, con epilessia refrattaria dall’età di 2 anni e ritardo psicomotorio. All’esame clinico: angiofibromi facciali, macule sul tronco e unghie con fibromi.
Questa è la RM encefalo:
Qual è la diagnosi più probabile?
- Ispessimenti cortico-sottocorticali
B. Glioma corticale multiplo
C. Metastasi cerebrali multiple
D. Encefalopatia ipossico-ischemica cronica
Risposta corretta: A
La sclerosi tuberosa è una malattia genetica autosomica dominante causata da mutazioni dei geni TSC1/TSC2, caratterizzata dalla formazione di tuber corticali, noduli subependimali, e lesioni in altri organi (reni, cuore, polmoni, pelle).
Caratteristiche radiologiche dei tuberi
- Tuberi corticali/subcorticali multipli:
- Ipo-intensi in T1, iperintensi in T2/FLAIR.
- Localizzazione fronto-parietale più comune.
- Noduli subependimali: lungo i ventricoli laterali, possono calcificare, a rischio di evoluzione in astrocitoma subependimale gigante (SEGA).
- Calcificazioni: visibili meglio in TC, lineari o puntiformi.
- Enhancement variabile nei tuberi; noduli subependimali possono mostrare enhancement significativo se in crescita.
- Possibile deformazione ventricolare, ma idrocefalo clinicamente significativo è raro fino allo sviluppo di SEGA.
Diagnosi differenziale
- Glioma corticale: di solito singolo, non multiplo, senza noduli subependimali.
- Metastasi cerebrali: raramente nei bambini, spesso con edema massivo e enhancement marcato.
- Encefalopatia ipossico-ischemica: lesioni corticali diffuse, simmetriche, senza noduli subependimali, calcificazioni o pattern caratteristici.
Importanza clinica
- La RM è fondamentale per mappare i tuberi, valutare rischio SEGA e guidare la chirurgia epilettogena.
- Il follow-up è essenziale per prevenire complicanze neurologiche (epilessia, ritardo cognitivo) e idrocefalo.
- La terapia può includere anticonvulsivanti, intervento chirurgico per tuberi epilettogeni e farmaci mTOR-inibitori per noduli subependimali in crescita.